[바이오번역 한경바이오인투] “알테오젠, 기술이전 성과 확인…후보물질 모멘텀 본격화 기대”
페이지 정보
작성자바이오인투 작성일 21-11-09 09:53본문
<한경바이오인투는 (주)한국경제신문이 운영하는 제약, 임상, 의학, 약학 분야에 특화된 바이오산업 전문 번역업체입니다.>
알테오젠은 피하주사(SC) 제형 전환 플랫폼 ‘하이브로자임(Hybrozyme)’에 대해 글로벌 제약사와 세 차례 기술이전 계약을 체결했다. 이후 성과들이 확인되고 있다는 설명이다.
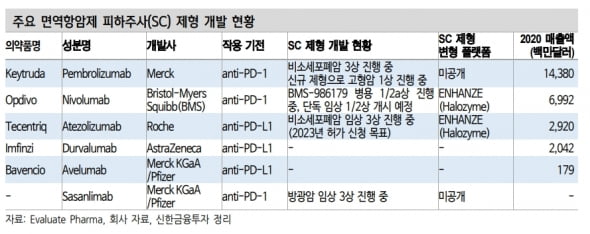
이동건 연구원은 “MSD는 지난 8월 신규 SC제형으로 ‘키트루다SC’를 개발하는 임상 1상 계획을 공개했다”며 “이번 임상은 이전 임상에서 표기되지 않은 성분명인 ‘MK-5180’과 키트루다를 적용한 임상으로, 새롭게 확보한 물질을 적용한 것으로 판단된다”고 말했다.
경쟁제품인 ‘옵디보’가 할로자임의 플랫폼을 적용해 SC제형을 개발 중인 만큼, 계약 특성상 키트루다SC는 알테오젠의 하이브로자임 플랫폼을 적용했을 것이란 추정이다.
사노피의 ‘사클리사SC’ 개발에도 알테오젠의 플랫폼이 적용됐을 가능성이 높다고 봤다. 이 연구원은 “최근 공개된 혈액항암학회(ASH 2021) 초록에서는 사노피의 사클리사SC 제형과 정맥주사(IV) 제형간 비교 임상 1b상 중간결과가 공개됐다”며 “재발성·불응성 다발성골수종 환자들을 대상으로 진행된 임상에서 앞서 진행된 사클리사IV 3상과 유효성 결과가 유사했고, 안전성에서도 특이사항이 보고되지 않았다”고 했다.
사클리사의 주요 경쟁 의약품인 얀센의 ‘다잘렉스’는 할로자임의 플랫폼을 통해 SC제형으로 상업화에 성공했다.
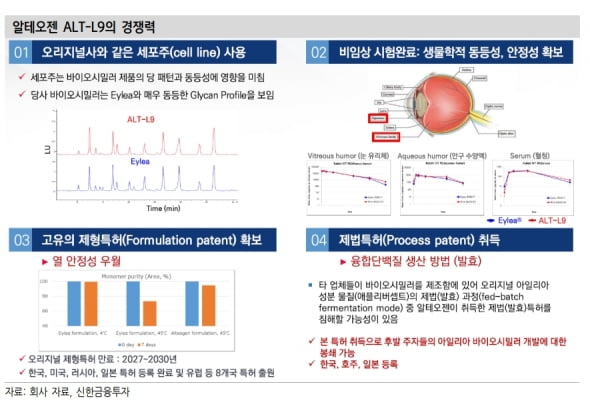
바이오베터(바이오의약품 개량신약) ‘테르카제’와 아일리아 바이오시밀러(바이오의약품 복제약) ‘ALT-L9’ 등 파이프라인들의 모멘텀도 본격화되고 있다고 했다.
알테오젠은 지난 9월 식품의약품안전처로부터 테르가제의 임상 1상을 승인받았다. 테르가제는 인간 히알루로니다아제 ‘ALT-B4’의 완제품이다. 1상에서 안전성 및 유효성을 입증하면 별도의 추가 임상 없이 즉시 품목허가 신청이 가능하다는 설명이다.
이 연구원은 “히알루로니다제 시장 규모는 약 8000억원으로, 2022년 하반기 허가를 받으면 현금창출원(캐시카우) 역할을 수행하며 유의미한 실적 기여를 할 것”이라고 말했다.
아일리아 바이오시밀러 임상 3상은 내년 상반기 개시할 것으로 예상했다. 현재 글로벌 유통 협력사 확보를 위한 논의를 진행 중이라고 했다. 1상에서 안전성과 유효성을 확인했고 고유 제형·제법 특허를 확보해, 협력사 확보 이후 개발이 가속화될 것으로 기대했다.
이 연구원은 “기술이전 이후의 성과들이 본격화되고 있는 가운데, SC제형 플랫폼에 대한 수요는 여전히 높다”며 “확인된 기술이전 성과들과 추가 기술이전, 파이프라인 모멘텀 본격화 등으로 알테오젠의 플랫폼에 대한 합당한 가치 반영이 필요한 시점”이라고 했다.
김예나 기자
관련링크
댓글목록
등록된 댓글이 없습니다.

