[바이오번역 한경바이오트랜스] 美·中서 특허받은 유틸렉스 'EU101', BMS·화이자 넘을까
페이지 정보
작성자바이오트랜스 작성일 20-08-19 09:14본문
<한경바이오트랜스는 (주)한국경제신문이 운영하는 제약, 임상, 의학, 약학 분야에 특화된 바이오산업 전문 번역업체입니다.>
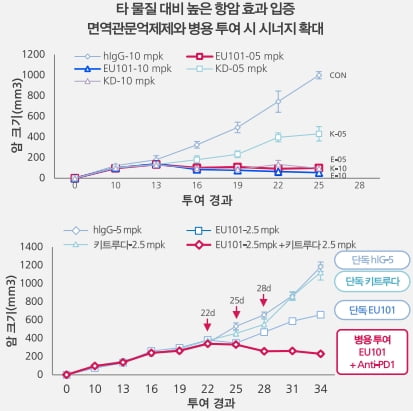
유틸렉스가 공개한 EU101의 효능 데이터. 유틸렉스 제공
유틸렉스(31,650 0.00%)가 T세포 공동자극 수용체 '4-1BB'를 표적으로 하는 면역항암제 'EU101'의 특허를 미국과 중국에서 취득하면서 4-1BB 항체에 대한 관심이 높아지고 있다.
14일 유틸렉스에 따르면 이 회사는 EU101 항체와 항원결합부위(에피토프)에 대한 독점적 권리를 미국에 이어 중국에서 확보했다. 특허 만료 기간은 2038년이다.
EU101은 T세포에 발현되는 공동자극 수용체 4-1BB를 자극해 T세포를 활성화하고 수를 늘린다. 키트루다와 옵디보 등은 암세포가 면역세포의 공격을 회피하는 데 관여하는 면역관문 단백질을 억제해 '면역관문억제제'라고 불린다. 반면 EU101은 T세포에 직접 작용해 T세포를 강화하기 때문에 유틸렉스는 '면역관문활성제'라는 명칭을 붙였다.
유틸렉스는 EU101이 경쟁사들의 4-1BB 항체보다 뛰어난 항암 효과를 보일 것으로 기대하고 있다. 항체가 항원에 붙는 성질이 다른 항체보다 강하고 항체의 효능에 영향을 미치는 에피토프가 우수하다는 이유에서다. 항체의 'Fc' 부위를 조작해 항체가 항원에 더 잘 붙는 것도 장점이다. 자체적으로 수행한 비교 임상에서 데이터도 확보했다.
기존 4-1BB 항체의 가장 큰 문제점으로 꼽히는 간독성도 전임상에서 나타나지 않았다는 게 회사 측 설명이다. 회사 관계자는 "중국에서 원숭이를 대상으로 GLP 독성시험을 성공적으로 마쳤다"며 "이 데이터는 임상시험계획(IND) 제출 시 포함된다"고 했다.
현재 4-1BB 항체를 개발 중인 글로벌 제약사는 BMS와 화이자다. 두 회사의 개발 과정은 녹록지 않았다. BMS의 우렐루맙은 임상시험에 처음 진입한 4-1BB 항체다. 전임상에서 획기적인 항암 효능을 보여 업계의 큰 주목을 받았다. 그러나 2008년 처음 발표된 임상 결과는 부정적이었다. 암을 제거하는 효과는 뛰어났지만 심각한 간독성이 나타났다. 4-1BB가 T세포에 많이 발현될수록, 용량을 높일수록 독성은 심해졌다. 사망자도 나왔다. BMS는 임상을 중단할 수밖에 없었다.
BMS는 2012년 다시 도전했다. 우렐루맙의 용량을 낮춰 단독 임상을 하거나 리툭산 옵디보 등과 병용하는 임상을 진행했다. 안전성은 괜찮았지만 효능이 좋지 않았다. 단독 임상에 참여한 60여명의 고형암 환자 중 우렐루맙에 반응을 보이는 환자가 없었다. 옵디보를 병용해도 환자들의 반응률은 낮았다. 일부 암종에서는 효능이 있었다. 비소세포폐암과 두경부암, 전이성 흑색종 등이다. 현재 BMS는 임상 3건을 진행하고 있다. 다른 임상 3건은 환자 모집 단계다.
화이자의 유토밀루맙은 안전하지만 단독으로는 효능이 크지 않다는 평가를 받는다. 화이자는 바벤시오 허셉틴 카보플라틴 키트루다 등 여러 항암제와 병용임상을 진행 중이다.
유틸렉스는 연내 국내와 미국에 임상 1상 시험계획(IND)을 제출할 계획이다. 결과를 지켜봐야 한다는 게 업계의 목소리다. 한 업체 대표는 "인간과 동물은 면역체계가 달라 면역항암제 분야에서 동물실험 데이터가 사람 임상으로 이어지지 않는 경우가 많다"며 "동물실험 결과는 우수하지 않았지만 임상시험에서 효과가 뛰어나 블록버스터가 된 키트루다 같은 사례도 있다"고 했다.
임유 기자 freeu@hankyung.com
ⓒ 한경닷컴, 무단전재 및 재배포 금지
관련링크
댓글목록
등록된 댓글이 없습니다.

